产品说明:
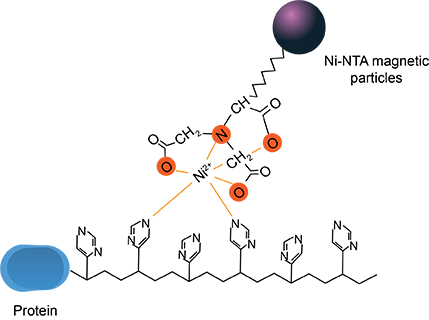
Ni-Mag磁珠适用于简单、快速、高效的从细菌、昆虫、哺乳动物细胞裂解液中直接纯化His-Tag融合蛋白。操作过程可以手动进行或在自动纯化仪中进行。Ni-Mag磁珠可用于表达克隆的筛选,以及表达条件(温度、培养基、宿主菌等)的优化研究。将Ni-Mag磁珠加入到适合的裂解液中,His-Tag融合蛋白在几分钟内即可与磁珠结合。未与磁珠结合的其他蛋白质通过Binding/Washing Buffer被漂洗除去,His-Tag目的蛋白可以通过含有咪唑的洗脱液回收获得。His-Tag融合蛋白可以在活性条件下,或在变性条件下纯化分离。
产品特点:
简单、快速:不需要传统柱层析纯化中多次高速离心、长时间过柱等处理。
兼容性强:Ni-Mag磁珠可以在多种常用的缓冲液体系中使用。
高效:1 mL的Ni-Mag磁珠可以结合高达1mg的His-Tag融合蛋白。
通用性强:操作过程可以手动进行或在自动纯化仪中进行。
组成:
| Component | NMP101-01 | NMP101-02 |
| Ni-Mag磁珠 【Ni-M】 | 1 mL | 2 mL |
自备设备:
磁力分离装置,振荡器。
注意事项:
- 本产品需与磁力分离装置配套使用。
- 在使用和保存过程中,避免对磁珠进行冷冻、干燥和高速离心等操作。
- 在使用前,务必使磁珠保持均匀的悬浮状态。
- 加入磁珠后,如果裂解液过于粘稠,可采用移液器反复吹打或漩涡振荡器使磁珠混合均匀。
- 磁珠不建议重复使用,如重复使用,尽量用于同一种蛋白的纯化。
操作步骤:
以下提供的操作步骤仅针对大肠杆菌表达系统活性条件下少量细胞内表达融合蛋白的纯化流程,仅供参考。对于大规模的纯化,可按比例提高相应试剂的体积。如纯化昆虫、哺乳动物细胞表达的His-Tag融合蛋白,用户可根据实际情况,自行调整设计实验,确定最佳的纯化步骤。
活性条件下纯化His-Tag融合蛋白
自备试剂:
Binding/Washing Buffer:
20 mM Tris-HCl,0.5 M NaCl,10 mM imidazole,pH 7.9
Elution Buffer:
20 mM Tris-HCl,0.5 M NaCl,500 mM imidazole,pH 7.9
操作步骤:
一、大肠杆菌裂解液的制备
- 样品处理(大肠杆菌细胞裂解可以采用超声波法处理,也可以采用本公司冻融法大肠杆菌蛋白提取试剂盒进行样品处理,下面进行一一介绍。)
A 采用超声波法对大肠杆菌细胞沉淀进行裂解:
a 取诱导表达后的大肠杆菌培养液至离心管中,12000 rpm离心2 min,弃去上清,收集菌体。
b 加入适量的Binding/Washing Buffer悬浮细胞,冰浴条件下超声波处理裂解细胞,即为粗蛋白样品。(可选择性加入蛋白酶抑制剂,如样品过于黏稠,可根据需要加入适量的DNase I,室温放置20-30 min。)
c 12000 rpm离心2 min,将上清转移到新的2 mL离心管中。
B 采用冻融法大肠杆菌提取试剂盒对大肠杆菌细胞进行裂解:
a 将1 ml大肠杆菌菌液加入到EP管中,7000 rpm离心2 min,弃上清,收集菌体。
b 加入180 µL无菌蒸馏水,通过移液器吹打悬浮菌体细胞。
c 加入20 µL 10×Lysis Buffer【Lysis B】,混匀。
d 再加入2 µL溶菌酶(Lysozyme)(50 mg/ml)【Lys】,-20℃冻存2 h,完全冷冻后进行下一步操作。(如果大体积的样品处理,可采用过夜冻存确保冷冻效果。)
e 在37℃水浴锅中孵育,每隔5 min,震荡混合均匀,直至完全融化。
f 加入2 µL CA Buffer【CA】,混匀,再加入2 µL DNase I(1 mg/ml),混匀。
g 在37℃水浴锅中孵育30 min,每隔5 min,震荡混合均匀,直至样品粘稠现象消失。
h 加入23 µL NA buffer【NA】,混合均匀。
i 12000 rpm离心2 min,收集上清,用于Ni-Mag磁珠【Ni-M】快速纯化。
C 针对胞外分泌表达蛋白的纯化:
a 取诱导表达后的大肠杆菌培养液至离心管中,12000 rpm离心2 min,将上清转移到新的离心管中。
b 加入等体积的Binding/Washing Buffer平衡,即为粗蛋白样品。
二、His-Tag融合蛋白的结合
- 加入20 µl Ni-Mag磁珠【Ni-M】(使用前,请将磁珠混合均匀),温和地上下翻转6-8次,充分混匀,室温静置3-5 min。(注:对于表达量很高的目的蛋白,可适当增加磁球的用量。)
三、漂洗
- 将离心管放于磁力架上1 min,待Ni-Mag磁珠完全吸至管壁之后,尽量吸除上清,从磁力架上移出离心管。
- 加入200 µl Binding/Washing Buffer,温和地上下翻转6-8次,充分混匀。将离心管放于磁力架上1 min,待Ni-Mag磁珠完全吸至管壁之后,尽量吸除上清,从磁力架上移出离心管。
- 重复步骤4四次。
四、洗脱
- 加入50 µl Elution Buffer,使用移液器反复吹打几次,使其充分混匀,室温静置3-5 min。
- 将离心管放于磁力架上1 min,待Ni-Mag磁珠【Ni-M】完全吸至管壁之后,收集洗脱液至新的离心管中,用于下游的实验。