产品说明:
该试剂盒采用Ni-Mag磁珠技术,结合自诱导、化学裂解系统,将大肠杆菌细胞中带有6×His标签的可溶性蛋白筛选出来,可实现高通量筛选。
大肠杆菌过夜自诱导表达系统适用于pET表达系统及其他IPTG诱导表达的依赖于lac启动子的大肠杆菌表达系统。整个诱导过程不需要监测菌体生长密度,不需要添加IPTG诱导剂。与传统的IPTG诱导培养方式相比较,自诱导有利于获得更大的菌体量和更多的目的蛋白。可用于常规的大肠杆菌表达系统表达异源蛋白,也可用于多种异源蛋白最优表达条件及可溶性表达条件的高通量快速筛选。
化学裂解系统可以温和的从大肠杆菌细胞中提取蛋白质,不需要超声波破碎仪等机械辅助。大肠杆菌中可溶性表达蛋白、包涵体蛋白均可以采用该试剂盒进行提取。该试剂盒可同时对多个样品进行蛋白质提取操作,具有操作简单、重复性好、效率高等优点
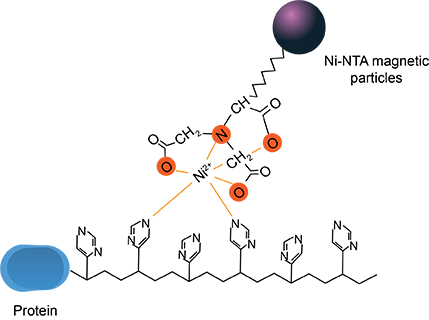
Ni-Mag金属离子螯合磁珠专为高效、快速纯化带有组氨酸标签蛋白而设计的一款产品,可通过磁性分离方式直接将目的蛋白从生物样品中分离出来,极大简化了纯化工艺和提高了纯化效率,可方便快捷地纯化带有组氨酸标签蛋白。
与传统的柱层析相比较,采用Ni-Mag磁珠无需对蛋白样品进行多次长时间的高速离心、过滤等操作,无需控制流速等复杂操作,也不需要昂贵的层析设备。一般1 h内就可以获得高纯度的目的蛋白。易于多样品平行处理,适于高通量蛋白质纯化。
该试剂盒可同时对多个样品进行蛋白质提取操作,具有操作简单、重复性好、效率高等优点。
试剂盒组成:
| Component | PP-M-50
(50 preps) |
PP-M-100
(100 preps) |
| Autoinduction Media(10×) | 5 mL | 10 mL |
| Lysis Buffer(10×) | 1 ml | 2 ml |
| Lysozyme(50 mg/ml) | 100 µl | 200 µl |
| DNase I(10 mg/ml) | 100 µl | 200 µl |
| CA Buffer | 100 µl | 200 µl |
| NA Buffer | 1.25 ml | 2.5 ml |
| Ni-Mag磁珠【Ni-M】 | 1 ml | 2 ml |
| Binding Buffer | 20 ml | 40 ml |
| Elution Buffer | 3 ml | 6 ml |
注意事项:
1.本产品需与磁力分离装置配套使用。
.在使用和保存过程中,避免对磁珠进行冷冻、干燥和高速离心等操作。
3.在使用前,务必使磁珠保持均匀的悬浮状态。
4.新鲜的或冻存的大肠杆菌菌体均可以采用该试剂盒进行提取蛋白质,对于冻存细胞,提取的效率更高。需根据菌体量来确定最佳的试剂使用量。
5.不依赖于EDTA的蛋白酶抑制剂、盐和还原剂等可直接加入到Easy Lysis Buffer中使用。如果不需要酶的处理,可在溶液中使用EDTA。
6.对于一些高表达量的蛋白,不添加溶菌酶和DNase I也不会显著影响提取蛋白的效率。如果溶菌酶和
DNase I可能会影响下游实验,提取过程中可以不使用溶菌酶和DNase I。
7.如果表达的目的蛋白不可溶、错误折叠或形成包涵体,推荐采用pNET系列带有不同融合标签的定向表达载体进行表达筛选,确定最佳融合标签。
8.大肠杆菌细胞裂解液适用于BL21等多种大肠杆菌宿主细胞,如果提取效率较低,可以通过在提取前冷冻菌体细胞来改善提取效率。
操作步骤:
大肠杆菌自诱导过夜培养
在常规LB或TB培养基中,加入Autoinduction Media(10×)即可进行自诱导操作。下面以配制50 mL自诱导培养液(用于50 次的筛选)为例,具体实验步骤如下:
1.配制LB或TB培养基,湿热灭菌。
2.在操作台无菌环境中,移取5 ml Autoinduction Media(10×)到步骤1中的LB或TB培养基中,混匀。
3.根据宿主和载体使用情况,加入相应的抗生素。
4.在操作台无菌环境中,将步骤3中配制好的培养液分装到灭菌后的玻璃试管中(如18×180 mm玻璃试管),每管1 ml。
4.接种:平板上的菌种接种1个单克隆即可;对于液体的菌种,以1-5%(v/v)比例接入非诱导的、处于对数生长期的菌种即可。
5.培养:37°C摇床中200 rpm过夜培养(约16 h)。
注:因不同蛋白的最佳表达温度和表达时间会有所差异,使用者可以根据实际情况进行调整优化。对于包涵体,可尝试通过37°C培养5 h,20°C培养20 h。
大肠杆菌细胞的裂解
1.将1 ml大肠杆菌菌液加入到1.5 mL或2 mL的离心管中,7000 rpm离心2 min,弃上清,收集菌体。
2.加入180 µL无菌ddw,通过移液器悬浮菌体细胞。
3.加入20 µL 10×Lysis Buffer,上下翻转3-5次,混合均匀。
4.再加入2 µL Lysozyme,上下翻转3-5次,混合均匀。-20°C冻存至少2 h或更长时间。
5.在37°C水浴锅中孵育,每隔5 min,上下翻转混合均匀,直至完全融化。
6.加入2 µL CA Buffer,上下翻转混合均匀,再加入2 µL DNase I,上下翻转混合均匀。
7.在37°C水浴锅中孵育30 min,每隔5 min,上下翻转混合均匀,直至样品粘稠现象消失。
8.加入23 µL NA buffer,上下翻转混合均匀。
9.12000 rpm离心2 min,收集上清,用于Ni-Mag磁珠快速纯化。
Mag-Ni磁珠纯化
1.通过震荡或移液器吹打,使Ni-Mag磁珠保持均匀的悬浮状态。通过移液器吸取20 µL Ni-Mag磁珠,加入到蛋白样品中,上下翻转3-5次混匀,室温放置2 min。
2.将离心管置于磁力架上2 min,待液体澄清后,使用移液器、真空吸取或通过翻转方式,尽量弃尽上清,然后从磁力架上取出离心管。
3.加入200 µl Binding Buffer,上下翻转5次摇匀。将离心管置于磁力架上2 min,待液体澄清后,使用移液器、真空吸取或通过翻转方式,弃尽上清,然后从磁力架上取出离心管。
4.重复操作步骤3一次。
5.加入60 µl Elution Buffer,上下翻转5次混匀,用手甩离心管,使液体聚集在离心管底部,室温放置2 min。
6.将离心管置于磁力架上1 min,待液体澄清后,吸取纯化后的蛋白液体到新的离心管中,用于SDS-PAGE分析或4°C保存备用。