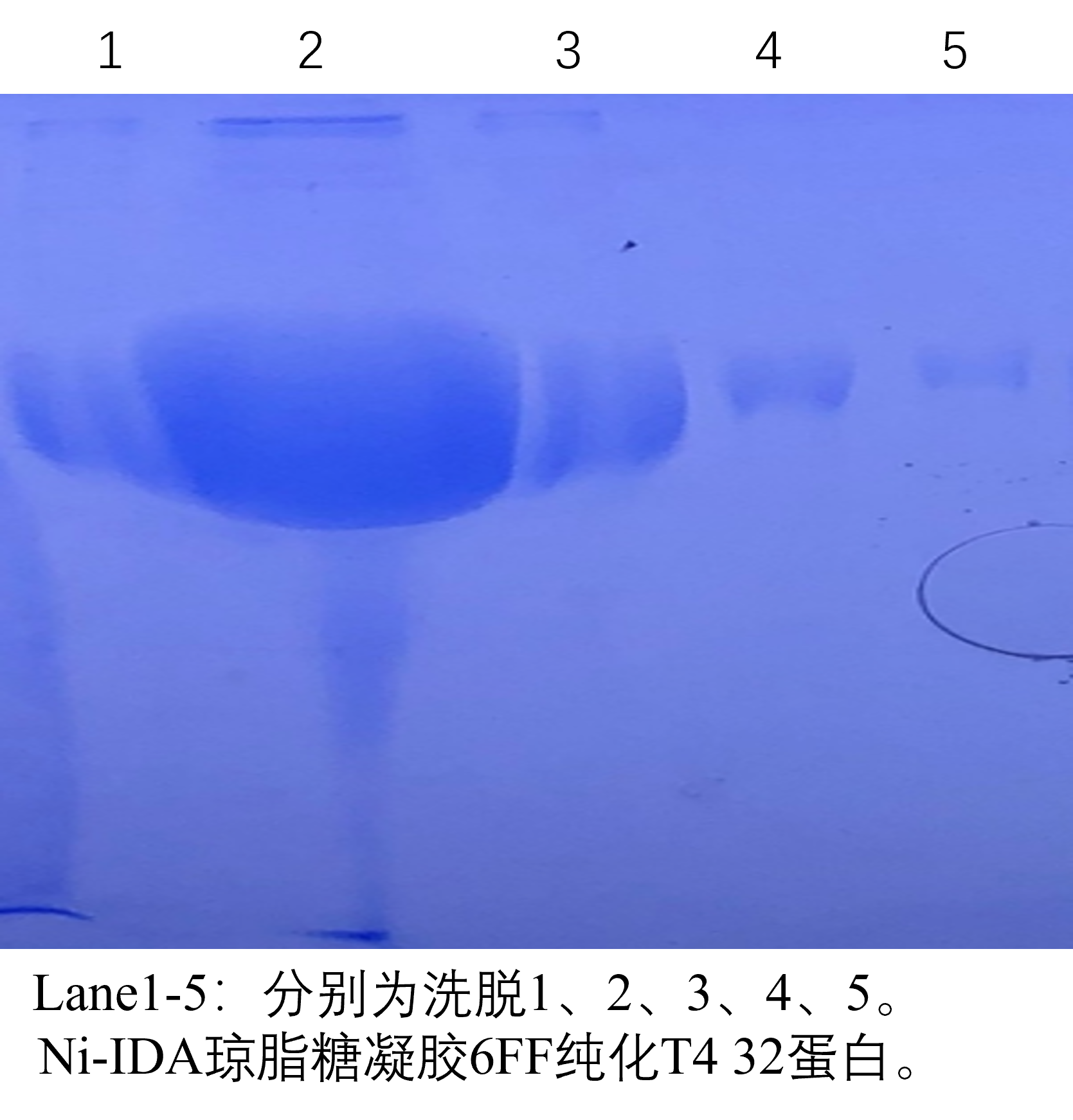
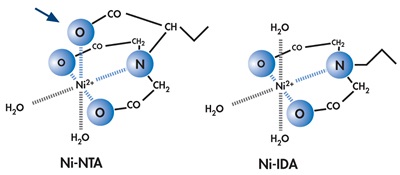
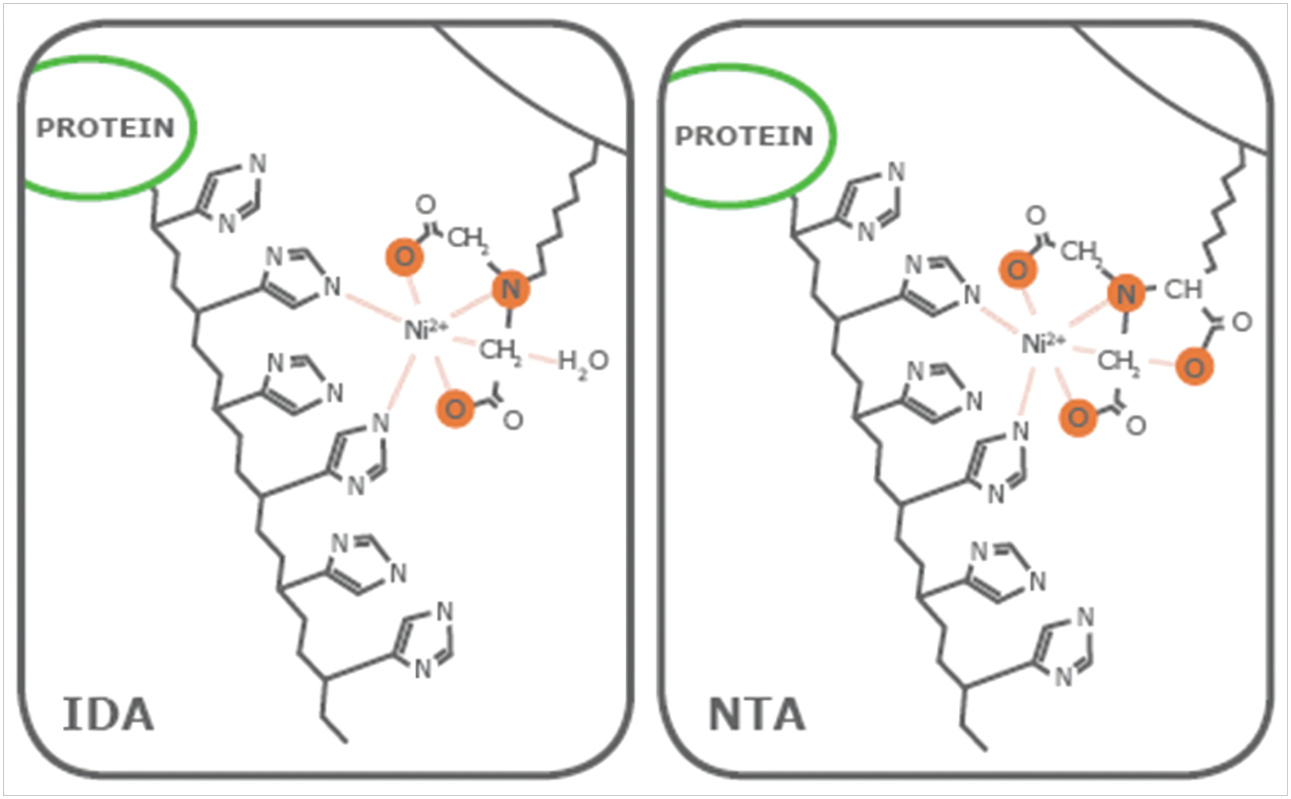
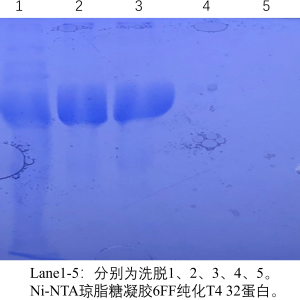
产品说明:
Ni-IDA琼脂糖凝胶6FF亲和层析介质采用IDA与6%高度交联琼脂糖凝胶共价偶联,再利用IDA的3个结合位点牢固的螯合Ni2+制备而成,再通过另外三个离子键结合部位高度特异性的亲和纯化含有多聚组氨酸标签的重组蛋白,未与介质结合的其他蛋白质被漂洗除去,His-Tag目的蛋白可以通过含有一定浓度的咪唑洗脱液回收获得。Ni-IDA琼脂糖凝胶6FF亲和层析介质的 Ni2+脱落程度很低,并具有吸附容量大、稳定性高、选择性好等优点,可以在变性和非变性条件下对含有多聚组氨酸标签的重组蛋白进行纯化。具体特性见下表:
Ni-IDA琼脂糖凝胶FF亲和层析介质的特征参数
| 特征参数 | 指标 |
| 基质 | 6% 高度交联琼脂糖凝胶 |
| 配基 | IDA |
| 平均粒径 | 90 µm (45-165 µm) |
| 动态承载量 | 20 mg/mL resin |
| 最大线性流速 | 600 cm/h (20 ml/min) (使用XK16/20纯化柱5 cm高) |
| 建议流速 | <150 cm/h |
| 最大耐受压力 | 0.3 MPa,3 bar |
| 储存溶剂 | 20%乙醇 |
| pH稳定性 | 3-12 |
组成:
| Component | PPM101-01 | PPM101-02 |
| Ni-IDA琼脂糖凝胶6FF | 5 mL | 25 mL |
注意事项:
1.在使用和保存过程中,避免对介质进行冷冻、干燥等操作。
2.为避免柱子堵塞,蛋白样品上样前,建议使用0.45 µm过滤器进行过滤。
操作步骤:
一、活性条件下纯化His-Tag融合蛋白
自备试剂:
Binding/Washing Buffer:
20 mM Tris-HCl,0.3 M NaCl,10 mM imidazole,pH 7.9
Elution Buffer:
20 mM Tris-HCl,0.3 M NaCl,500 mM imidazole,pH 7.9
Ni2+亲和柱的制备
1.上下翻转混匀Ni-IDA琼脂糖凝胶6FF,然后取一定体积装入到层析柱中,介质自然沉降,并流干储存液。(介质自然沉降后为1个柱体积。)
2.加入5倍柱体积的去离子水冲洗树脂。
3.加入5倍柱体积的Binding/Washing Buffer(pH7.9)平衡树脂,放置待用。
裂解液的制备
4.本树脂适合从细菌、酵母、昆虫、哺乳动物细胞等裂解液中纯化His-Tag融合蛋白,用户可根据实际情况,自行调整设计实验,确定最佳的裂解方案。
5.裂解液在4°C,1,2000 rpm 离心10 min,收集上清液备用。
His-Tag融合蛋白的结合
6.将含His-Tag重组蛋白的澄清样品上样至纯化柱中,流出流速控制在<150 cm/h,收集流出液待后续分析。
漂洗
7.加入5-10个柱体积的Binding/Washing Buffer (pH7.9)进行洗柱,或者直到流出液的 A280值达到最低且稳定。
洗脱
8.加入5-10个柱体积的Elution Buffer (pH7.9)进行洗脱,收集洗脱液。或者根据流出液A280数值进行判断,当数值急剧上升时开始收集洗脱液,直到A280数值降至最低且稳定时停止收集。
9.根据目的蛋白的性质和用途,可以采用葡聚糖G-25凝胶或透析袋将储存液更换到相应的溶液中备用。